
Длительный COVID (или постковидный синдром) — это состояние проявляющееся совокупность долгосрочных симптомов, которое развивается у 10–20% пациентов с COVID-19. Наиболее распространенные проявления постковидного синдрома включают респираторные и сердечно-сосудистые симптомы, утомляемость и непереносимость физических нагрузок1,2. Длительный COVID часто ассоциируется с фибротическими рентгенологическими изменениями легких и рестриктивными легочными изменениями, которые в совокупности известны как легочные осложнения после перенесенного COVID-19 3 .
Гиалуроновая кислота (ГК), основной компонент внеклеточного матрикса, идентифицируется как ключевой медиатор воспаления и фиброза. Исследования показывают, что воздействие на ГК с помощью гиалуронидаз уменьшает воспаление и препятствует образованию фиброза, особенно в моделях фиброза легких 4,5. Более того, избыточная продукция ГК способствует развитию как острого, так и постострого COVID-19 6.
Лонгидаза® (бовгиалуронидаза азоксимер) — это полимер-конъюгированная гиалуронидаза с благоприятным профилем безопасности, подтвержденным более чем 3 миллионами доз, произведенных за 20 с лишним лет для 8 стран мира.
Недавно проведенное исследование продемонстрировало эффективность препарата Лонгидаза® в улучшении легочной функции и переносимости физических нагрузок у пациентов с остаточными изменениями в легких после перенесенного COVID-19 7.
Мы провели рандомизированное двойное слепое плацебо-контролируемое клиническое исследование «Long-CoV-III» для дальнейшей оценки возможного влияния препарата Лонгидаза® на легочные осложнения после перенесенного COVID-19.
Рандомизированное, двойное слепое, плацебо-контролируемое исследование у пациентов с остаточными изменениями в легких и рестриктивными легочными заболеваниями, одышкой и десатурацией кислорода в покое или после физической нагрузки. Исследование проводилось в 37 центрах. Было рандомизировано 392 пациента в 2 группы в соотношении 1:1. Пациенты получали внутримышечные инъекций Лонгидаза® (3000 МЕ) или плацебо каждые 5 дней в течение 71 дня. После завершения терапии пациенты переходили в 109-дневное последующее наблюдение. Эффективность оценивалась в полной аналитической выборке из 376 пациентов, которые успешно завершили исследование.
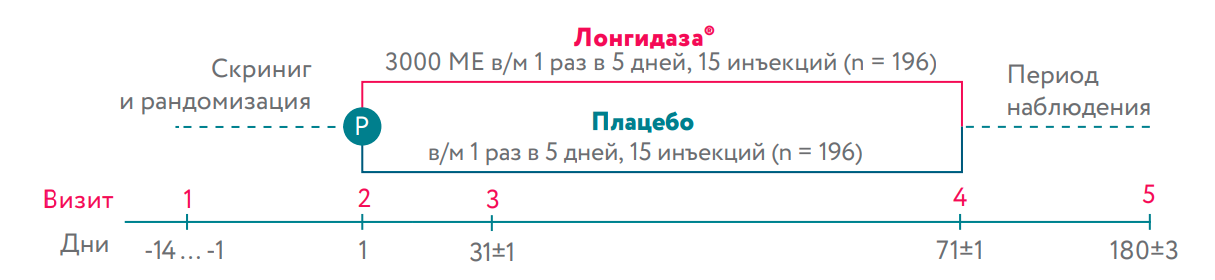
В итоге 392 пациента были рандомизированы в исследовании и получали Лонгидазу ® или плацебо; 382 пациента завершили исследование. Все рандомизированные пациенты были включены в анализ безопасности, в то время как Полный набор анализа (FAS популяция) включал 376 пациентов (186 Лонгидаза ®, 190 плацебо). Пациенты были исключены из FAS популяции в первую очередь из-за несоответствия критериям рестриктивного заболевания легких (ФЖЕЛ<80%, ОФВ1/ФЖЕЛ>70%).

- Изменение значений показателя ФЖЕЛ (% от долж.) по сравнению с исходными значениями по данным спирометрии после завершении курса терапии к 71 дню
- Изменение значений ФЖЕЛ (% от долж.) по сравнению с исходным значением после завершения периода наблюдения к 180 дню
- Доля пациентов с увеличением значения показателя ФЖЕЛ (% от долж.) на 10% и более по сравнению с исходными значениями после завершения курса терапии к 71 дню и периода наблюдения к 180 дню.
- Доля пациентов, у которых наблюдается десатурация капиллярной крови при физической нагрузке (определяемая как снижение SpO2 ≥4% после выполнения 6-минутного теста ходьбы (6-МШТ)) после завершения курса терапии к 71 дню и периода наблюдения к 180 дню.
- Доля пациентов с изменением выраженности одышки при оценке по шкале Борга после 6-МШТ после по сравнению с исходными значениями на ≥ 2 балла после завершения курса терапии к 71 дню и периода наблюдения к 180 дню.
- Доля пациентов с увеличением пройденной дистанции в 6-МШТ на 50 м и более по сравнению с исходными значениями после завершения курса терапии к 71 дню и периода наблюдения к 180 дню
- Доля пациентов с уменьшением выраженности одышки при оценке по шкале mMRC по сравнению с исходными значениями на ≥ 1 балл после завершения курса терапии к 71 дню и периода наблюдения к 180 дню.
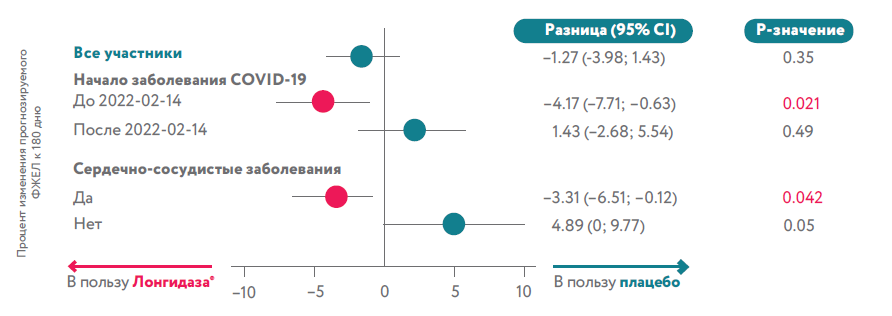
Для анализа подгрупп пациенты были стратифицированы по дате начала COVID-19 (до 14 февраля 2022 г. или после этой даты); по возрасту (≤60 лет по сравнению с >60 лет); по полу; по наличию сопутствующих сердечно-сосудистых заболеваний, определенных по классам систем органов MedDRA.
Применение Лонгидаза® приводило к более быстрому восстановлению ФЖЕЛ у пациентов с сердечно-сосудистыми заболеваниями (n=281, diff=-3,31%, p=0,042) и у пациентов с более ранней инфекцией COVID-19 (n=188, diff=-4,17%, p=0,021). В общей популяции в группе Лонгидаза® наблюдался незначительный тренд прироста ФЖЕЛ.
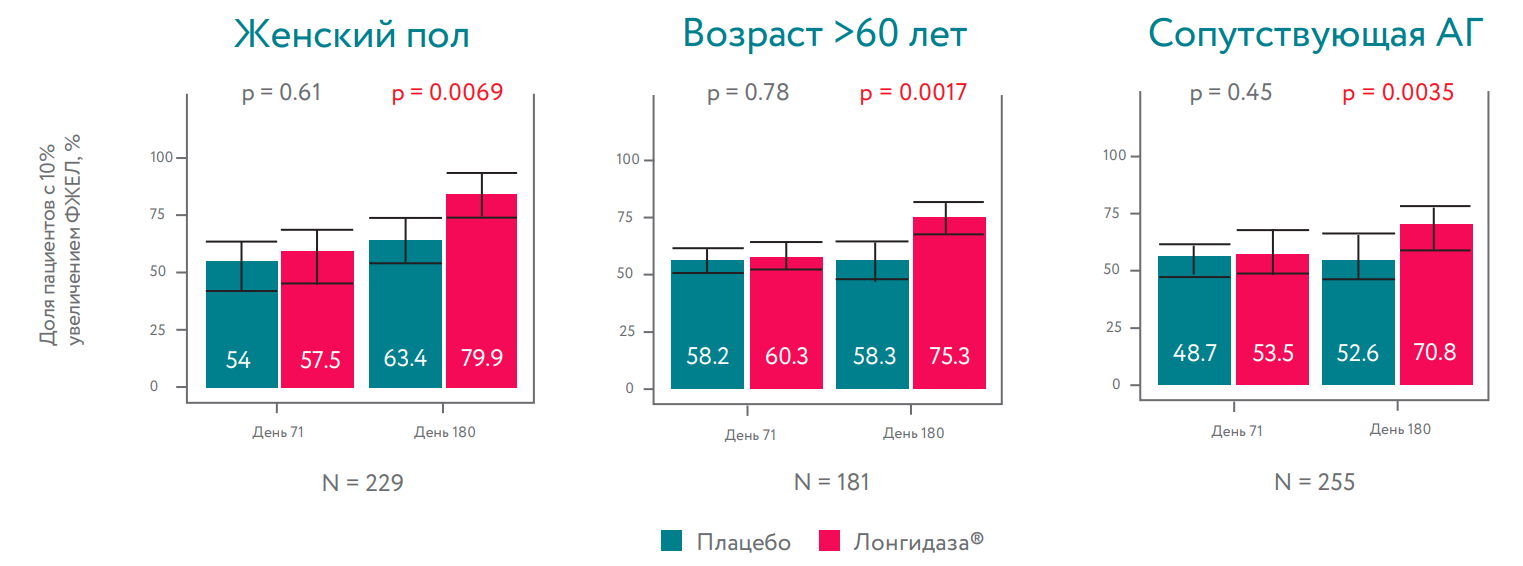
Лонгидаза® приводила к значимому повышению доли пациентов с 10% увеличением ФЖЕЛ среди женщин всех возрастов, пациентов старше 60 лет и пациентов с эссенциальной гипертензией к 180 дню.
В общей популяции в группе Лонгидаза® наблюдалась тенденция к увеличению доли пациентов, достигших ≥10% роста ФЖЕЛ. На 180-й день 68% пациентов в группе Longidaza ® и 58,4% пациентов в группе плацебо показали по крайней мере 10% увеличение ФЖЕЛ от исходного уровня (OR=1,51; p=0,058).
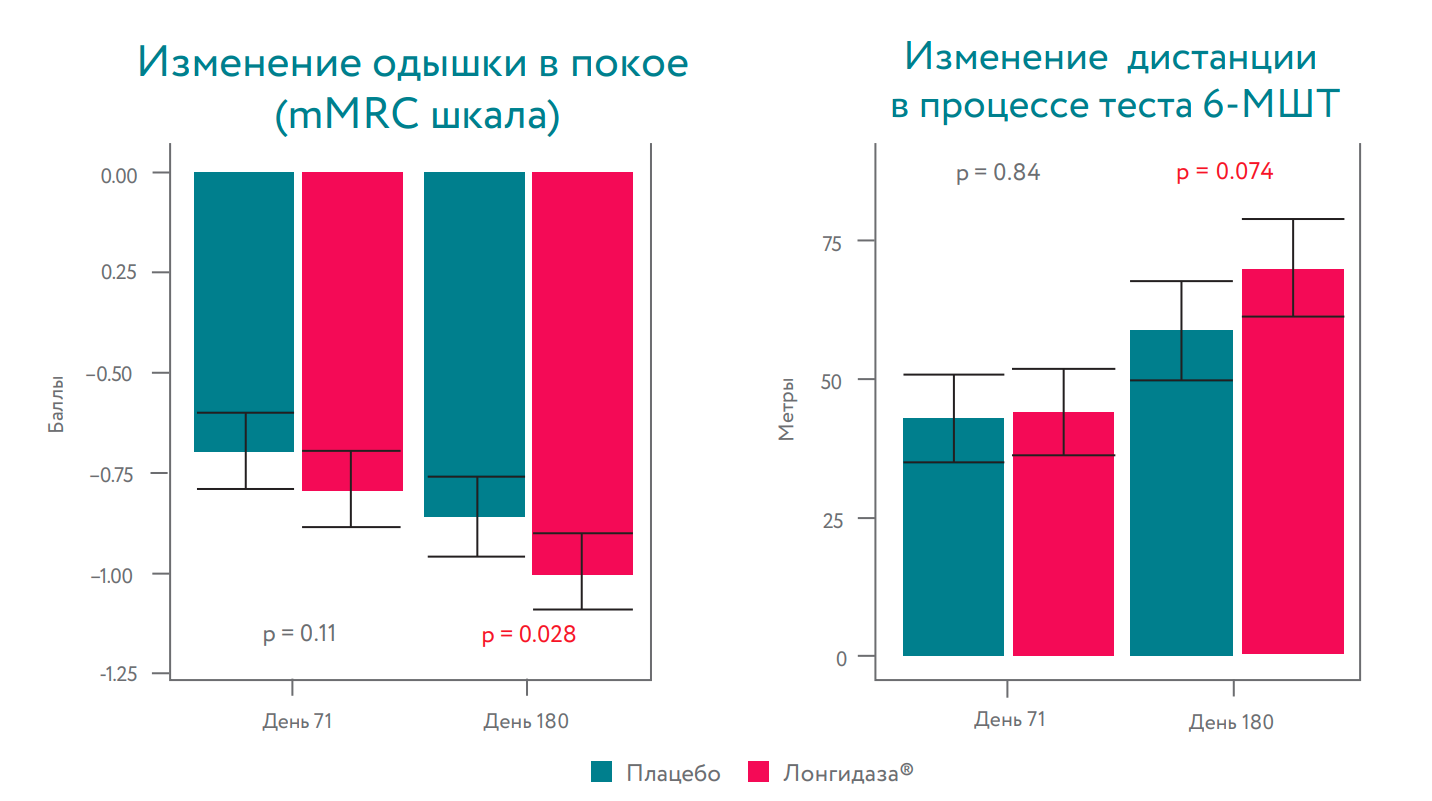
Препарат Лонгидаза® значимо снижал доли пациентов, испытывающих десатурацию и одышку после теста с шестиминутной ходьбой (6-МШТ) на 71-й и 180-й дни.

Лонгидаза® ассоциировалась со значительным уменьшением одышки в состоянии покоя и тенденцией к увеличению дистанции, пройденной в тесте 6-МШТ к 180-му дню.
У семидесяти трех (37%) из 196 пациентов в группе Лонгидаза ® и у 49 (25%) из 196 пациентов в группе плацебо наблюдались нежелательные явления во время исследования. Восемь несерьезных нежелательных явлений у семи пациентов были признаны, как связанные с Лонгидазой®. К ним относились три реакции в месте инъекции и отдельные случаи повышения уровня аланинаминотрансферазы, С-реактивного белка, тромбоцитопении, крапивницы и стенокардии. У одного участника, получавшего плацебо, наблюдался случай тромбоцитопении, который считался связанным с лечением. У трех пациентов в группе Лонгидаза ® наблюдались серьезные нежелательные явления, но они не были связаны с Лонгидазой®. Нежелательные явления привели к прекращению терапии у пяти пациентов, получавших Лонгидазу ®, и у одного пациента в группе плацебо.
| Событие | Лонгидаза | Плацебо |
|---|---|---|
| количество пациентов (%) | ||
| Любые нежелательные явления | 73 (37,2) | 49 (25) |
| Наиболее частые нежелательные явления | 73 (37,2) | 49 (25) |
| - Инфекции дыхательных путей | 11 (5.6) | 13 (6.6) |
| Серьезное неблагоприятное событие | 3 (1,5) | - |
| - Гастроэнтерит | 1 (0,5) | - |
| - COVID-19 | 1 (0,5) | - |
| - Холецистит | 1 (0,5) | - |
| Нежелательное явление, приведшее к прекращению исследуемого лечения | 5 (2,5) | 1 (0,5) |
| - COVID-19 | 3 (1,5) | 1 (0,5) |
| - Кандидоз | 1 (0,5) | - |
| - Желудочно-кишечные заболевания | 1 (0,5) | - |
| Нежелательное явление, связанное с исследуемым препаратом | 7 (3,6) | 1 (0,5) |
| - Реакция на инъекцию у 3 пациентов и крапивница у 1 пациента | 3 (1,5) | - |
| - Повышенный уровень С-реактивного белка | 1 (0,5) | - |
| - Повышение аланинаминотрансферазы | 1 (0,5) | - |
| - Тромбоцитопения | 1 (0,5) | 1 (0,5) |
| - Стенокардия | 1 (0,5) | - |

Avdeev, Sergey N., et al. "Bovhyaluronidase azoximer for long-term pulmonary sequelae of COVID-19: a randomized, double-blind, placebo-controlled trial." medRxiv (2024): 2024-09.
- Davis, Hannah E., et al. "Characterizing long COVID in an international cohort: 7 months of symptoms and their impact." EClinicalMedicine 38 (2021).
- Cai, Miao, et al. "Three-year outcomes of post-acute sequelae of COVID-19." Nature medicine (2024): 1-10.
- Singh, Sally J., et al. "Respiratory sequelae of COVID-19: pulmonary and extrapulmonary origins, and approaches to clinical care and rehabilitation." The Lancet Respiratory Medicine 11.8 (2023): 709-725.
- Pakhomova, Angelina, et al. "Anti-Inflammatory and Antifibrotic Potential of Longidaza® in Bleomycin-Induced Pulmonary Fibrosis." Life 13.9 (2023): 1932
- Nagy, Nadine, et al. "4-methylumbelliferone treatment and hyaluronan inhibition as a therapeutic strategy in inflammation, autoimmunity, and cancer." Frontiers in immunology 6 (2015): 123./li>
- Barnes, Henry W., et al. "Hyaluronan in the pathogenesis of acute and post-acute COVID-19 infection." Matrix Biology 116 (2023): 49-66.
- Chuchalin, A. G., et al. "Efficacy and safety of bovhyaluronidase azoximer (Longidaza®) in patients with post-COVID syndrome: results of an open, prospective, controlled, comparative, multicenter clinical trial DISSOLVE." Pulmonologia 33.1 (2023): 52-63.

Предложение в онлайн-аптеке
Хочу купить!Выгода до
500 рублей

получи скидку с выгодой до 500 рублей при покупке двух упаковок Лонгидазы
Промокод действует на АПТЕКА.РУ с 01.05.2025 по 31.07.2025
Заказать на Аптека.руРеклама. Рекламодатель ООО «НПО Петровакс Фарм»



